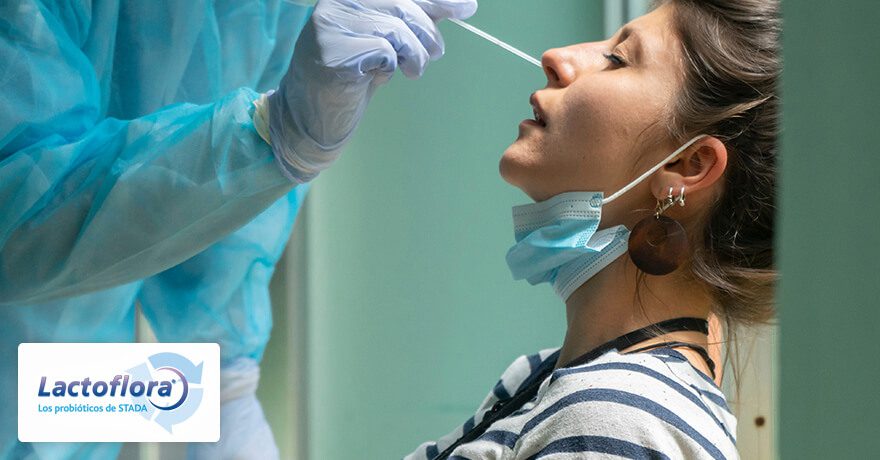
A raíz de la pandemia que se inicio en China en 2019, se dio a conocer el SARS CoV21, durante estos casi 2 años donde se han observado los efectos en fase aguda de la infección que pueden producir graves secuelas y una alta letalidad, en paciente frágil y añoso, se ha observado una nueva entidad, COVID persistente, pacientes que más allá de las 12 semanas desde el inicio de la sintomatología persiste la clínica, esa clínica es tremendamente múltiple afectando a diferentes órganos y sistemas destacando, la astenia, la confusión mental , la cefalea, la disnea que producen una afectación de la calidad de vida con disminución del estado de salud.2
Esa variabilidad desde infectado asintomático hasta paciente muerto por infección causada por SARS CoV-2, es hoy la gran pregunta a resolver, seguramente medien varios factores: factores genéticos, arquitectura celular del huésped, factores virales, sitio de entrada y respuesta del huésped a la infección3,4.
Relación entre microbiota intestinal y COVID-19
La microbiota intestinal humana está formada por más de un billón de microorganismos en un ecosistema complejo y dinámico, que regula el sistema inmunológico y toda nuestra fisiología. La flora intestinal desempeña funciones muy importantes en el cuerpo, incluido el metabolismo nutricional, el desarrollo y modulación de la inmunidad, así como la defensa contra patógenos dañinos . En el tracto gastrointestinal (TGI), la barrera epitelial protege contra la invasión de microorganismos patógenos y ayuda a mantener la tolerancia a los antígenos alimentarios, mientras que también puede estar asociada con funciones inmunes sistémicas y pulmonares. Una vez dañada, los microorganismos se trasladan al torrente sanguíneo o los pulmones y pueden inducir septicemia o síndrome de dificultad respiratoria aguda.5
Se ha sugerido que la composición de la microflora intestinal juega un papel en esta enfermedad debido a lo siguiente:
a) su relevancia para una respuesta eficaz del sistema inmunológico;
b) el hecho de que el 5-10% de los pacientes presentan síntomas gastrointestinales;
y c) porque está modulado por la enzima convertidora de angiotensina 2 intestinal (ACE2) (que es el receptor del virus).
Además, se sabe que los pacientes más gravemente afectados (aquellos que permanecen más tiempo en el hospital, que requieren cuidados intensivos, y que finalmente mueren) son personas mayores con enfermedades cardiovasculares, metabólicas, renales y pulmonares preexistentes, las mismas personas en las que la prevalencia de disbiosis de la microflora intestinal es mayor.5 Los pacientes con COVID-19 que presentan malos resultados son también aquellos en los que la hiperreactividad del sistema inmunológico y una condición inflamatoria grave (denominada colectivamente “tormenta de citocinas”) son particularmente evidentes y se han asociado con un fenotipo de microbiota deteriorado.6
De hecho, existe evidencia de una interferencia entre el tracto respiratorio y el TGI, o más precisamente, entre la microbiota intestinal y los pulmones , y esta conexión se denomina eje intestino-pulmón. Los cambios en la composición taxonómica y la disminución de la diversidad y función de la microbiota intestinal, conocida como disbiosis, pueden afectar la inmunidad de los pulmones .5
Las manifestaciones prolongadas del TGI en COVID-19, principalmente la diarrea, se correlacionan con la disminución de la riqueza y diversidad de la microbiota intestinal, la desregulación inmune y el retraso en la eliminación del SARS-CoV-2. Entonces, las interacciones bidireccionales entre la mucosa respiratoria y la microbiota intestinal, conocidas como eje intestino-pulmón, se supone que participan en las respuestas inmunitarias sanas o patológicas al SARS-CoV-2.
De acuerdo con esto, la disbiosis intestinal se asocia con un aumento de la mortalidad en otras infecciones respiratorias, debido a una inflamación exacerbada y una disminución de los mecanismos reguladores o antiinflamatorios en los pulmones y en el intestino, lo que apunta a esta importante relación entre ambos compartimentos mucosos. Por lo tanto, dado que las membranas mucosas de los tractos respiratorio y gastrointestinal se ven afectadas, además de la disbiosis y la inflamación, es plausible suponer que las terapias complementarias basadas en la modulación de la microbiota intestinal y el restablecimiento de las condiciones de eubiosis podrían ser un tratamiento terapéutico importante para limitar las consecuencias dañinas de COVID-19.5
El SARS-CoV-2 puede causar inflamación local en el intestino y podría conducir a una coinfección aprovechando el sistema inmunológico suprimido que resulta en una infección severa, especialmente entre los ancianos. El nuevo virus provoca disbiosis del microbioma intestinal facilitando potencialmente su invasión y supervivencia. El microbioma intestinal alterado predispone a los pacientes a infecciones microbianas secundarias y diseminación del virus a otras partes del cuerpo7.
Se ha descrito que los pacientes con síntomas prolongados tienen una abundancia significativamente mayor de microbiota que induce inflamación, como los miembros del género Prevotella y Veillonella . Cabe destacar las especies que producen lipopolisacáridos y la similitud del microbioma oral de los pacientes con COVID prolongado con los de los pacientes con síndrome de fatiga crónica. En conjunto, estos hallazgos sugieren una asociación con el microbioma oral y COVID prolongado, lo que revela la posibilidad de que la disfunción del microbioma oral pueda contribuir a la persistencia de la sintomatología.8
La disbiosis gastrointestinal
La disbiosis gastrointestinal es la causa o el efecto de las manifestaciones gastrointestinales y varias manifestaciones sistémicas graves, que pueden ser la respuesta a un entorno proinflamatorio aumentado, merece una mayor investigación. Dada la semejanza del microbioma en los pacientes con COVID-19 con el que se observa en los pacientes con lupus, resulta más claro por qué varias terapias utilizadas en enfermedades autoinmunes se encuentran actualmente bajo investigación para el tratamiento de pacientes con COVID-19.9
Se ha estudiado en serie de casos la microbiota intestinal de pacientes con COVID-19 recuperados y las correlaciones entre la microbiota intestinal y los síntomas persistentes después del alta. Los pacientes con clínica persistente habían reducido la diversidad bacteriana a los tres meses después del alta, con una abundancia relativa significativamente mayor de patógenos oportunistas, y una abundancia relativa significativamente menor de bacterias beneficiosas. Además, Escherichia no clasificada se correlacionó positivamente con síntomas persistentes a los tres meses después del alta, incluyendo fatiga (r = 0.567, p = 0.028), opresión en el pecho después de la actividad (r = 0.687, p = 0.005) y mialgia (r = 0.523, p = 0.045 ). Intestinibacter bartlettii se correlacionó positivamente con anorexia (r = 0,629, p = 0,012) y fatiga (r = 0,545, p = 0,036). Sin embargo, Faecalibacterium prausnitzii se correlacionó negativamente con la opresión en el pecho después de la actividad (r = −0,591, p = 0,02) e Intestinimonas butyriciproducensse correlacionó negativamente con la tos (r = −0,635, p = 0,011). La microbiota intestinal de los recuperados con COVID-19 a los tres meses después del alta era diferente a la de los pacientes con covid persistente, y la microbiota intestinal alterada se correlacionó con síntomas persistentes después del alta, destacando que la microbiota intestinal puede desempeñar un papel importante en la recuperación de pacientes con COVID-19.1
Durante el proceso de infección, los virus tienen interacciones cercanas con las bacterias comensales del huésped. Si bien la microbiota puede regular la respuesta frente a las infecciones virales, también puede ser modificada por los virus, lo que lleva a una disbiosis bacteriana.11 En el huésped, las vías respiratorias superiores, el revestimiento epitelial y el sistema inmunológico local son cruciales para la prevención de la infección. Es importante destacar que la microbiota del huésped participa activamente en la homeostasis de la mucosa y la resistencia a las infecciones. Una microbiota nasal saludable puede ser importante para evitar una infección viral 12 y podría ayudar a predecir el resultado y reducir las complicaciones. Además de la composición de la microbiota local, ya se han informado cambios en la microbiota intestinal y del tracto respiratorio inferior en pacientes con COVID-19 13.
Existe evidencia de que la microbiota intestinal puede comunicarse con otras partes del cuerpo. El reconocimiento de que la microbiota intestinal influye en varias vías de señalización ha llevado al concepto del eje intestino-cerebro y, más recientemente, del eje intestino-pulmón (14,15). La comunicación de señales bidireccionales entre el tracto gastrointestinal y el cerebro o los pulmones es vital para el huésped humano. Como resultado, los cambios en la microbiota intestinal, especialmente los causados por enfermedades o intervenciones médicas, están relacionados con la homeostasis alterada y las respuestas inmunes16. Las alteraciones en la microbiota intestinal se han asociado con cambios en las respuestas inmunes y inflamación en los pulmones, así como desarrollo de enfermedades respiratorias17.
Por otro lado, la persistencia de resultados positivos de RT-PCR para SARS-CoV-2 es muy intrigante en los pacientes con enfermedad prolongada por COVID-19 18,19. Aún no está claro si la presencia viral se debe a la existencia de virus infecciosos viables o al ARN genómico remanente 20,21.
Conclusión
La microbiota es crucial para la salud humana y es esencial para las respuestas inmunes. La coinfección microbiana aumenta el riesgo de gravedad de la enfermedad en humanos. Sin embargo, su mecanismo de interacción con el virus infectante con otros patógenos aún no está claro. Es muy importante estudiar la fuente y el mecanismo de los patógenos coinfectantes. Esto ayudará en el diagnóstico temprano y a comprender la terapia para tratar eficazmente la enfermedad. Es necesario explorar el uso de microbiota para la salud, probióticos y otros regímenes de promoción de la salud para contrarrestar las coinfecciones durante la pandemia de COVID-19.
Por todo ello una de las líneas de investigación en auge es justamente tener conocimiento del papel cualitativo y cuantitativo del microbioma del huésped , y con ello ayudar a dianas terapéuticas que restablezcan ese equilibrio homeostático perdido.
Referencias:
- https://www.who.int/es/emergencies/diseases/novel-coronavirus-2019?adgroupsurvey={adgroupsurvey}&gclid=Cj0KCQjw1dGJBhD4ARIsANb6OdnttmnkDncXa6prBtUlOrWKtFa2KZB19F33EKjdD0gXMhqpnoBAGSEaAnI_EALw_wcB
- Lopez-Leon S, Wegman-Ostrosky T, Perelman C, Sepulveda R, Rebolledo PA, Cuapio A, Villapol S. More than 50 long-term effects of COVID-19: a systematic review and meta-analysis. Sci Rep. 2021 Aug 9;11(1):16144.
- Ovsyannikova IG, et al. The role of host genetics in the immune response to SARS-CoV-2 and COVID-19 susceptibility and severity. Immunol Rev. 2020; 296(1):205-219.
- Toyoshima Y, et al. SARS-CoV-2 genomic variations associated with mortality rate of COVID-19. J Hum Genet. 2020; 65(12):1075-1082.
- De Oliveira GLV, Oliveira CNS, Pinzan CF, de Salis LVV, Cardoso CRB. Microbiota Modulation of the Gut-Lung Axis in COVID-19. Front Immunol. 2021 Feb 24;12:635471. doi: 10.3389/fimmu.2021.635471. PMID: 33717181; PMCID: PMC7945592.
- Ferreira C, Viana SD, Reis F. Is Gut Microbiota Dysbiosis a Predictor of Increased Susceptibility to Poor Outcome of COVID-19 Patients? An Update. Microorganisms. 2020 Dec 28;9(1):53.
- Mohapatra RK, Dhama K, Mishra S, Sarangi AK, Kandi V, Tiwari R, Pintilie L. The microbiota-related coinfections in COVID-19 patients: a real challenge. Beni Suef Univ J Basic Appl Sci. 2021;10(1):47.
- Haran JP, Bradley E, Zeamer AL, Cincotta L, Salive MC, Dutta P, Mutaawe S, Anya O, Meza-Segura M, Moormann AM, Ward DV, McCormick BA, Bucci V. Inflammation-type dysbiosis of the oral microbiome associates with the duration of COVID-19 symptoms and long-COVID. JCI Insight. 2021 Aug 17:152346. doi: 10.1172/jci.insight.152346. Epub ahead of print. PMID: 34403368.
- Katz-Agranov N, Zandman-Goddard G. Autoimmunity and COVID-19 – The microbiotal connection. Autoimmun Rev. 2021 Aug;20(8):102865.
- Zhou, Y., Zhang, J., Zhang, D., Ma, WL y Wang, X. (2021). Vinculación de la microbiota intestinal con síntomas persistentes en sobrevivientes de COVID-19 después del alta. Revista de Microbiología , 1-8.
- De Oliveira GLV, Oliveira CNS, Pinzan CF, de Salis LVV, Cardoso CRB. Microbiota Modulation of the Gut-Lung Axis in COVID-19. Front Immunol. 2021 Feb 24;12:635471. doi: 10.3389/fimmu.2021.635471. PMID: 33717181; PMCID: PMC7945592.
- Hanada S, et al. Respiratory Viral Infection-Induced Microbiome Alterations and Secondary Bacterial Pneumonia. Front Immunol. 2018; 9:2640.
- Grier A, Gill AL, et al. Temporal Dysbiosis of Infant Nasal Microbiota Relative to Respiratory Syncytial Virus Infection. J Infect Dis. 2020:jiaa577.
- Kaźmierczak-Siedlecka K, et al. COVID-19 – gastrointestinal and gut microbiota-related aspects. Eur Rev Med Pharmacol Sci. 2020 Oct; 24 (20):10853-10859.
- Cryan JF, et al. The Microbiota-Gut-Brain Axis. Physiol Rev. 2019; 99(4):1877-2013.
- Budden KF, et al. Emerging pathogenic links between microbiota and the gut-lung axis. Nat Rev Microbiol. 2017 Jan; 15(1):55-63.
- Rizzetto L, et al. Connecting the immune system, systemic chronic inflammation and the gut microbiome: The role of sex. J Autoimmun. 2018;92:12-34.
- Marsland BJ, et al. The Gut-Lung Axis in Respiratory Disease. Ann Am Thorac Soc. 2015; 12(Suppl 2):S150-6.
- Gupta S, et al. Persistent viral shedding of SARS-CoV-2 in faeces-a rapid review. Colorectal Dis. 2020; 22(6):611-620
- Aguirre Chang, Gustavo & Trujillo Figueredo, Aurora. (2021). SCIENTIFIC STUDY DEMONSTRATES THAT PERSISTENT SYMPTOMS OF COVID ARE CAUSED BY SARS COV-2 VIRUS INFECTION NOT DETECTABLE WITH PCR USING SWABS.. https://www.researchgate.net/publication/354343036_SCIENTIFIC_STUDY_DEMONSTRATES_THAT_PERSISTENT_SYMPTOMS_OF_COVID_ARE_CAUSED_BY_SARS_COV-2_VIRUS_INFECTION_NOT_DETECTABLE_WITH_PCR_USING_SWABS
- Rodriguez-Grande C, et al. Inference of active viral replication in cases with sustained positive RT-PCRs for SARS-CoV-2. J Clin Microbiol. 2021 Jan 21;59(2):e02277-20. 34) Pedersen SF, Ho YC. SARS-CoV-2: a storm is raging. J Clin Invest. 2020; 130(5):2202-2205.
Autor
-

Médico de familia, IP Esperanza COVID-19, Coordinador del comité expertos COVID persistente DAP Costa Ponent ICS, Investigador colaborador del IDIAPJGOl y del IDIBELL, Asesor del comité de COVID persistente del COMB, Presidente Fundador del CIR LongCovid
Ver todas las entradas













2 respuestas
Buenos dias,
estoy con síntomas después de pasar SARS-COV2.
Niebla mental, pitidos en los oídos, cansancio, dolores brazos y piernas.
Estoy convencido que tengo permeabilidad intestinal.
¿Cree Que podría ayudarme?
Gracias.
Le recomendamos que visite a un médico para que pueda hacerle pruebas y diagnosticarle. Si su sintomatolgía es digestiva , el uso de probióticos le podría beneficiar para reequilibrar su microbiota intestinal.